Ⅲ期肺癌の過去、現在、未来 その1
現在Ⅲ期肺癌に関して大きな変革がもたらされてきています。
周術期での免疫チェックポイント阻害薬や分子標的薬の使用、根治化学放射線治療後の免疫チェックポイント阻害薬などが標準的な治療になりつつあります。
これらの新しい治療方法が出てきてはいますが、今一度まずは、今までのⅢ期肺癌の治療戦略に関して振り返っていこうと思います。
そもそもⅢ期肺癌(規約第8版)といっても大きく分けると、
①切除可能なⅢ期肺癌
②切除不能なⅢ期肺癌
に分けられます。
切除可能か不能かを分ける指標は施設によって変わり、外科、内科、放射線治療科の3者で協議する必要があります。通常N3症例(対側縦隔、対側肺門部、鎖骨上窩リンパ節)に関しては、手術適応はなく、CRT(化学放射線治療)もしくは全身化学療法の適応となります。
N1症例に関しては、基本は手術(+術後化学療法)の方針になりますが、bulky N1 (短径20mm以上)など根治には肺全摘が回避出来ない症例に関しては、CRT適応となる事が多いです。
悩ましいのはN2症例であり、ガイドラインでもⅢA期N2症例に関して、multi station N2(N2領域に複数のリンパ節転移あり)の場合やbulky N2といった手術適応のない症例以外は、N2の評価を気管支鏡検査(EBUS-TBNA)などで組織学的に術前行う事が推奨されています。
ただ、Checkmate816試験の結果を元に以前まででは手術適応のなかったN2ⅢA症例に関して、術前化学療法+ICI → 手術の可能性も提示さえる様になるのではないかと思われます。
同じⅢ期でもSST(肺尖部胸壁浸潤癌)では、術前にCRTを行う事もあり、治療方針は異なります。
周術期が今は話題の中心ですが、まずは切除不能3期症例(主にCRT症例)に関して振り返って参りたいと思います。
(続く)
PPIがICIの効果を減弱する可能性
Efficacy of first-line atezolizumab combination therapy in
patients with non-small cell lung cancer receiving proton pump
inhibitors: post hoc analysis of IMpower150
British Journal of Cancer (2022) 126:42–47;
https://doi.org/10.1038/s41416-021-01606-4
ICIの効果を減弱させる可能性のある薬はいくつか報告があります。ステロイドは機序を考えれば、妥当ですが、抗菌薬も報告があります。(JAMA oncology. 2019 12 01;5(12);1774-1778.)
抗菌薬による腸内細菌叢の破綻がICIの効果を減弱させている可能性が示唆されています。抗PD-1/PD-L1抗体で治療した患者の腸内細菌と抗腫瘍効果との関係があるという報告もあります。(Gut microbiome influences efficacy of PD-1-based immunotherapy against epithelial tumors. Science. 2018;359:91-7.)
腸内細菌叢は免疫に大きく関係している事が以前から知られています。
今回紹介する論文では、IMPOWER150試験の事後解析です。IMPOWER150試験では、ABCP(Atezolizumab+Bevacizumab+CBDCA+PTX)がBCPに対して有意に全生存期間を有意に延長させました。(OS median:19.8 months vs. 14.9 months , HR: 0.764 , 95%CI:0.630-0.926)
ただ、今回の論文では、PPIの内服が独立した予後不良因子であったとの事で、
PPIにより胃酸が減少し、腸管細菌叢が修飾される事で、ICIの効果減弱されるのではないかという事でした。
不要なPPIは可能であれば減薬すべきと思われます。
背景:プロトンポンプ阻害剤(PPI)は、がん治療の併用薬として一般的に使用されており、腸管の微生物叢の変化を引き起こす。
腸内細菌叢異常が免疫チェックポイント阻害剤(ICI)の効果を低下させることが明らかになりつつある 。しかし、ICI、特にICIと化学療法の併用のアウトカムに対するPPIの影響についてはほとんど知られていない。
方法:第III相試験IMpower150のポストホックCox比例ハザード解析を実施し、PPIとICIの関連性を評価した。
化学療法未治療の転移性非扁平上皮非小細胞肺癌において、PPI使用と全生存期間(OS)および無増悪生存期間(PFS)との関係を検討した。
非小細胞肺がん患者を対象に、アテゾリズマブ+カルボプラチン+パクリタキセル(ACP)、ベバシズマブ+カルボプラチン+パクリタキセル(BCP)もしくはアテゾリズマブ+BCP(ABCP)をランダム化した。PPIの使用は、30日以内にPPIを投与した場合と定義した。
結果:1202人の参加者のうち、441人(37%)がPPIを使用した。アテゾリズマブ群(ACP+ABCP)において、PPIの使用は、OSの悪化と独立して関連していた(n = 748; hazard比(HR)[95%信頼区間(CI)]=1.53[1.21-1.95]、P<0.001)、PFS(1.34[1.12-1.61]、P=0.002)。この関連はBCPでは明らかではなかった(n=368、OS 1.01 [0.73-1.39], P = 0.969; PFS 0.97 [0.76-1.25] , P = 0.827).
アテゾリズマブ(ACP+ABCP)群対BCPのOS治療効果(HR 95%CI)は、1.03 (PPI使用群で1.03(0.77-1.36)、非使用群で0.68(0.54-0.86)でした(P=0.028)。また、同様の関連は ABCP対BCPにも認められた。(PPI:0.96 [0.68-1.35]; PPI非使用者:0.66 [0.50-0.87]; P= 0.095 )
結論: PPI使用は、ACPまたはABCPで治療された患者において予後不良のマーカーであったが、BCPではそうでなかった。PPIがICIの効果に悪影響を及ぼすということが今回の検討で示唆された。
KYENOTE407試験長期フォローアップデータ+リアルワールドデータ
J Clin Oncol. 2023 Feb 3;JCO2201990.
doi: 10.1200/JCO.22.01990.
JTO Clinical and Research Reports Vol. 4 No. 2: 100444. DOI:https://doi.org/10.1016/j.jtocrr.2022.100444
KEYNOTE-407試験長期フォローアップデータがJCOから、アメリカでのリアルワールドデータがJTOから出ていました。
全体集団におけるOS中央値が、KEYNOTE-407では17.2ヶ月に対して、リアルワールドデータでは15.3ヶ月で、何れもPD-L1の発現に関わらずOSが有意に延長していたとの事です。
KEYNOTE-407でPembrolizumab 35サイクル完遂出来た人のresponse rateは90.9%、ランダム化後の5年生存率は69.5%と長期生存が得られている結果でした。
切除不能・再発の非小細胞肺癌(扁平上皮癌)に対する標準治療として揺るぎない感じですね。
Pembrolizumab Plus Chemotherapy in Squamous Non–Small-Cell Lung Cancer: 5-Year
Update of the Phase III KEYNOTE-407 Study
第III相であるKEYNOTE-407試験の5年間の有効性と安全性の結果について報告する。
対象は、前治療歴のない転移性扁平上皮非小細胞癌(NSCLC)患者で、ペムブロリズマブ200mgまたはプラセボとカルボプラチンとパクリタキセル/ナブ-パクリタキセルを3週毎4サイクルして、最大35サイクルまでペンブロリズマブもしくプラセボを続ける治療に1:1で無作為に割り付けられた。
主要評価項目は、全生存期間(OS)および無増悪生存期間(PFS)とし、RECISTバージョン1.1で盲検独立中央審査(BICR)により評価された。
559人の患者を無作為にintention-to-treat集団で割り付けされた。(ペムブロリズマブ+化学療法、n=278、プラセボ+化学療法、n=281)
無作為割付けからデータカットオフまでの時間の中央値は56.9(範囲:49.9-66.2)ヶ月であった。OSとPFSは、ペムブロリズマブ+化学療法がプラセボ+化学療法に対してそれぞれ改善した。(ハザード比[95%CI]、0.71[0.59~0.85]、0.62[0.52~0.74])
5年OS率はそれぞれ18.4 vs 9.7%であった。毒性は管理可能であった。
ペムブロリズマブ35サイクルを完遂した55人の患者で、客観的奏効率は90.9%、3年OS率は(無作為割付から約5年後)は69.5%であった。ペムブロリズマブ+化学療法は、プラセボ+化学療法に対してOSおよびPFSの優位性を維持した、前治療歴のない転移性
扁平上皮NSCLCに対してPD-L1の発現に関係無く、標準的な1st lineでの治療選択肢である。
First-Line Pembrolizumab Plus Chemotherapy for Advanced Squamous NSCLC: Real-World Outcomes at U.S. Oncology Practices.
Introduction:
ペンブロリズマブ+(nab-)パクリタキセル(ペンブロリズマブ-化学療法)は最近では、前治療歴の無い扁平上皮NSCLCに承認され、推奨される全身化学療法となっている。この後方視的研究では、アメリカにおいて、実臨床でペンブロリズマブ-化学療法を1次治療で行った扁平上皮NSCLCに対するリアルワールドデータでの治療期間(rwToT)と全生存期間(OS)を評価した。
方法:
リアルワールドでのデータベースを用いて、成人の新たに診断された、進行または再発した扁平上皮NSCLC(切除不能なステージIIIB、IIIC、またはIV)で、2018年11月1日から2020年5月31日までにペムブロリズマブ-化学療法を開始したPS良好(ECOG-PS:0-1)の患者を対象とした。
カプランマイヤー法により、PD-L1発現に応じて、rwToTとOSを決定した。
データカットオフは2021年10月31日であった。
結論:
対象患者364名のうち、243名(67%)は男性であった。
年齢中央値は70(範囲:43-84)歳、PD-L1発現が1%以上、1%未満、不明はそれぞれ172名(47%)、94名(26%)、98名(27%)であった。
ペムブロリズマブ-化学療法開始時からデータカットオフまでの期間は、26.2カ月であった。全体として、ペムブロリズマブのrwToTの中央値は、6.5ヶ月(95%信頼区間[CI]:5.6-7.6)で、12ヶ月および24ヶ月時点の治療継続率は29.3%および15.9%であった。
OS中央値は15.3カ月(95%CI:11.7-18.6)。12ヶ月および24ヶ月OS率はそれぞれ54.9%、37.3%であった。OS中央値はPD-L1発現に関係無く、PD-L1:1%以上で16.2ヶ月(95%CI:10.3-20.6)。1%未満で17.2ヶ月(95%CI:10.8-20.6)であった。
結論:
1次治療でペンブロリズマブー化学療法をPS良好な進行扁平上皮NSCLC患者に行う事で、rwToT、OSは臨床試験の結果と同等に近い結果となった。
KISEKI試験(WJOG12819L)
Lung Cancer 177 (2023) 44–50
A phase II study (WJOG12819L) to assess the efficacy of osimertinib in
patients with EGFR mutation-positive NSCLC in whom systemic disease
(T790M-negative) progressed after treatment with first- or
second-generation EGFR TKIs and platinum-based chemotherapy
Masayuki Takeda et al.
EGFR-TKI既治療、EGFR:T790M陰性に対するオシメルチニブの有効性を検証した第2相試験の結果です。患者家族会発案、医師主導治験というとても珍しい形の試験と思います。
EGFR:T790Mの陽性率は40~55%(肺癌患者におけるEGFR遺伝子変異検査の手引き第4.2版)でRELAY試験の結果でも、治療進行後のエルロチニブ耐性によるEGFR:T790M発現率はRAM+ERL群47%、ERL群50%との事でした。
実臨床では1次治療に第一もしくは第二世代のTKIで治療し、増悪後に再生検してT790Mを確認して、オシメルチニブを投与出来る患者は3割程度と言われています。
現実的には1次治療に第一もしくは第二世代のTKIで治療した患者では、2次治療にオシメルチニブを使用出来ない患者もいるので、今回の結果を元にしてオシメルチニブの適応拡大に繋がれば良いのかもしれませんが、どうなるのでしょうか。
もし適応拡大になれば、RELAYレジメンの使用は増えるのではと考えています。
背景 :オシメルチニブは、第3世代の上皮成長因子受容体(EGFR)チロシンキナーゼ阻害剤で、化学療法未治療のEGFR遺伝子変異陽性非小細胞肺がん(NSCLC)患者さんに対する標準治療として確立されている。 しかし、そのような前治療歴のある患者さんのうち 、第一世代または第二世代のEGFR TKIを使用した場合、オシメルチニブ治療の対象となるのが約半数となるのは、T790M陽性の転移性NSCLCに限り、2次治療以降の適応となっているからである。
本試験は、日本の肺癌患者ネットワークの要請により開始された。
方法:第1世代または第2世代のEGFR TKIとプラチナベースの化学療法による治療後(T790M陰性)に進行したEGFR変異陽性NSCLC患者を対象に、オシメルチニブの有効性を評価する第2相試験を実施した。主要評価項目は、奏効率である。
結果:2020年8月~2021年2月までに15の施設から55人の患者が参加した。初回の解析時点で主要評価項目である全奏功は、16人の患者で達成し、(29.1 %; 95 % CI, 17.6–42.9) 解析に必要な奏効率の閾値を上回った。
SDは16人(29.1%)、PDは18人(32.7%)。無増悪生存期間(PFS)の中央値は4.07ヶ月(95%信頼区間2.10-4.30)で、12ヶ月PFSの割合は17.3%であった。
結論:オシメルチニブは、進行性のEGFR T790M陰性例に対して中等度の抗腫瘍活性を示した。
呼吸器診断学3
肺腫瘤陰影をみた時の診断の流れを確認していきます。
日本CT検診学会のガイドラインに基づいた、肺結節陰影のフローチャートをお示しします。


充実性性結節と部分充実/スリガラス陰影で対応が異なっています。
充実性結節
10mm以上もしくは、10mm以下でも経過観察中に増大傾向がある時(2mm以上の増大)がある時には、確定診断を行う事が推奨されています。
確定診断の方法に関しては以下の方法があります。
① 気管支鏡検査
② CTガイド下生検
③ 局所麻酔下胸腔鏡
④ 手術生検
⑤ その他 (リンパ節生検、皮膚転移の生検、EUS/FNAなど)
それぞれどの様なメリット、デメリットなどがあるかを表にしてまとめてみました。

気管支鏡検査を行うかどうかは、「腫瘍に枝が入っているかどうか」が重要になります。「bronchus sign」とも言います。事前に1~2mm厚のHRCTを用意しておくと、気管支鏡の枝読みには有用です。
最近では進行肺癌の治療前には各種遺伝子変異、PD-L1の検索が必須になっています。以前はEGFRやALKなどを1つずつ提出していましが、現在ではオンコマインDx®などの
NGSやAmoyDx®といったマルチ遺伝子PCRを使用して遺伝子変異を検索します。そのためにはある程度の組織量が必要となります。(オンコマインDxの場合5μmの未染スライド10枚)
手術や放射線治療前で「診断のみ」で良い患者と、進行肺癌で今後化学療法を要する患者で「診断に加えて、バイオマーカー検索も必要」という患者では気管支鏡検査での検体の質と量が異なってきます。
気管支鏡検査ではEBUS-GSという、超音波とシースを使用した方法が一般的で、診断率が70%程度から80%程度まで向上すると言われています。その反面、シースを使用するので鉗子のサイズが小さくなり、組織量が減ります。
組織量をカバーするために生検回数を増やすか、超音波で腫瘍の存在を確認した後にあえて、組織量を確保するために、シースを使わずに通常の鉗子を使用して組織量を増やす方法もあります。また最近ではクライオ端子を使用して凍結させた検体を取ってきて、確実な組織量を担保する方法も出てきています。
EBUS-TBNAといって、縦隔リンパ節(#2、#4、#7、#10、#11など)を超音波を用いて穿刺して、組織を採取する方法もあります。慣れると案外、通常の鉗子を用いた生検よりも確実に組織を確保出来る様になります。
末梢の原発巣と縦隔リンパ節転移があり、リンパ節が刺しやすい(#7、#4Rなど)の時にはあえて原発を生検せず、十分な組織を確保するために縦隔リンパ節にEBUS-TBNAでアプローチする場合も多いです。
ただ、気管支鏡検査で診断するだけで無く、診断したその先も意識した組織採取が求められている時代になっています。
その点CTガイド下生検や局所麻酔下胸腔鏡の場合はバイオマーカー検索にも耐えられる様な確実な組織量を確保しやすいとは言われています。
CTガイド下生検は、気管支鏡が届かない末梢病変や腫瘍に気管支の枝が入っていない病変では良い適応になります。(肺尖部や肺底部などは気管支鏡が届かない病変の代表です)
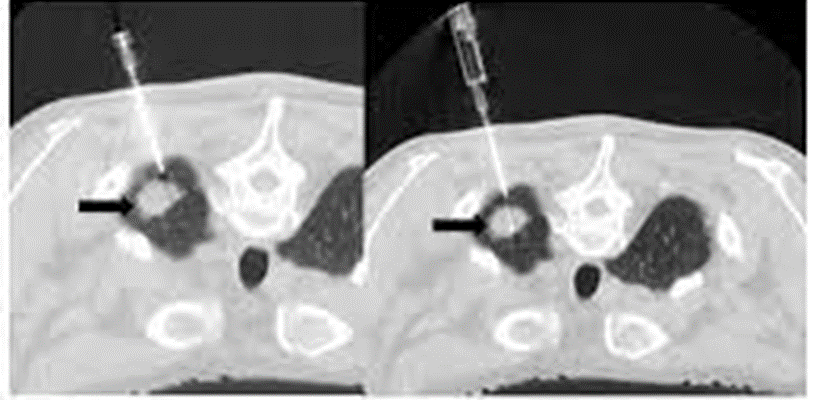
(日本IVR学会HPより)
CTガイド下生検は肺だけでなく、CTガイド下で骨や胸膜を生検する場合もあります。
CTガイド下生検が望ましくないのは
・原発巣が小さく安全な穿刺が困難
・肺門部や縦隔など病巣が中枢側にある
・仰臥位での安静が困難
などがあります。
原発巣が小さく、胸水は無いものの遠隔転移がありバイオマーカー検索は必要ではあるものの、気管支鏡も届かず、CTガイド下生検にも局所麻酔下胸腔鏡も困難な場合があります。
その場合でも確実な診断と組織量を得る努力は必要になります。
上記で示していない肺癌の診断オプションとしては、EUS-FNAがあります。
アグレッシブな施設では呼吸器内科医がEUS-FNAを自分で行う所もあるみたいですが、多くは消化器内科に依頼します。
具体的には食道から縦隔にある病変をEUS-FNAで採取したり、胃に送気して膨らませて左副腎からEUS-FNAで組織採取する方法もあります。
それでも組織採取が難しい時にはⅣ期で進行した肺癌にもかかわらず、組織採取のために手術をお願いする場合もあります。
そこまで進行肺癌に対する組織採取の重要性が増してきているのです。
Osimertinib PD後の2次治療に関して
FLAURA試験の結果を元にOsimertinibを1st lineから使用する事は標準的となっています。ただ、問題となるのはOsimertinibがPDとなった後の2nd line以降の治療戦略です。
肺癌診療ガイドラインでは、1st lineでOsimertinib PD後の2nd lineとしては「遺伝子変異/転座陰性、PD-L1 TPS:50%未満、もしくは不明の一次治療」と記載されています。
その中でも年齢とPSで治療方針は異なり、
・PS0~1、75歳未満 ⇒ プラチナ製剤併用±PD-1/PD-L1阻害薬、ペンブロリズマブ単剤(PD-L1≧1%)、ニボルマブ+イピリムマブ併用
・PS0~1、75歳以上 ⇒ 細胞障害性抗癌剤単剤、プラチナ製剤併用±PD-1/PD-L1阻害薬、ペンブロリズマブ単剤(PD-L1≧1%)
となっています。
PS0~1、75歳未満に関して
具体的に日本の保険診療で使用可能なレジメンを上記の条件に照らし合わせて列挙すると、、、
(ここでは、EGFR陽性肺癌であり、non-small , non-Sqに絞って記載しています。)
① CBDCA( or CDDP)+PEM+Pembrolizumab (Keynote189試験)
② CBDCA+PTX+Atezolizumab+bevacizumab (IMpower150試験)
③ CBDCA+nab-PTX+Atezolizumab (IMpower130試験)
④ CBDCA+PTX+Nivolumab+Ipilimumab (Checkmate9LA試験)
⑤ Pembrolizumab (Keynote042試験)
⑥ Nivolumab+Ipilimumab (Checkmate227試験)
となります。では一体どれを使用すれば良いのでしょうか?
まず、それぞれの根拠となる臨床試験ではEGFR遺伝子陽性例が含まれていたのかを確認していきます。EGFR陽性が含まれていたのは、②と③のIMpower150と130試験でした。他の試験ではEGFR患者は除外されており、EGFR陽性患者への効果は不明です。
IMpower150試験に関しては、肺癌をされている方には常識かもしれませんが、subgroup解析でEGFR陽性患者に関しても有効な可能性がありました。

n engl j med 378;24 nejm.org June 14, 2018
EGFR陽性例ではHR:0.59という事で41%のリスク減少で良い様な気がします。
ただ気をつけないといけない事は、EGFR陽性患者はCBDCA+PTX+Atezo+Bev(ABCP)を受けた全体の8.8%(35/400人)しかいませんでした。35人とコントロール群の45人の比較の上に事前に設定された評価項目では無いsubgroup解析であり、鵜呑みにして、ABCPを積極的に使用する根拠には乏しい様に思われます。
またIMpower130試験はどうであったかというと、まず登録可能な症例はEGFR/ALK変異陽性で、TKI治療に不耐もしくは病勢進行後に登録可能との事でした。化学療法+ICI(CBDCA+nab-PTX+Atezo)群は合計483人でそのうちEGFR or ALK陽性者は32人(7%)でした。患者数が少ないもののEGFR・ALK陽性患者に限ればHR:0.98で1をまたぎ、優位な効果は得られませんでした。
ちなみに主要評価項目は、遺伝子変異陽性患者を除いたwild typeのITT集団におけるPFS、OSでした。
PFS中央値:7.0ヶ月(vs 5.5ヶ月)HR:0.64
OS中央値:18.6ヶ月 (vs 13.9ヶ月)HR:0.79
EGFR陽性かつPD-L1≧50%で、TKI未治療患者にPembrolizumabを投与した研究(J Thorac Oncol. 2018 August ; 13(8): 1138–1145. )がありますが、有効性は示されず、EGFR陽性・PD-L1:高発現患者への1st line のICI使用をすべきでは無いという結論でした。
なので、EGFR陽性者に関してPD-L1が高発現であってもKeynote024試験に準じたPembrolizumab単剤は避けた方が良いと思われます。
(抗PD-1単剤療法は、喫煙歴のない人が多いこと、TMBが低いこと、腫瘍T細胞の浸潤が少ないことなどが原因で、臨床効果が低いことが分かっているそうです)
ではNivolumab+Ipilimumabはどうでしょうか。こに組み合わせに関してもEGFR陽性患者では良い結果は得られていません。
EGFR陽性で、1st line でTKIがPDになったNSCLC患者を対象にNIvolumab vs Nivolumab+Ipilimumabを比較した第2相試験があります。(Lancet
. 2019 May 4;393(10183):1819-1830. doi: 10.1016/S0140-6736(18)32409-7. Epub 2019 Apr 4.)
この試験は無益性のため早期中止になりましたが、合計31人の患者が参加し、16人がNivo+ipi、15人がNivoに割り付けられ、それぞれPFS中央値が1.22ヶ月 vs 1.31ヶ月 p=0.96とPFSも短く、Ipilimumabの上乗せ効果もありませんでした。
結局のところ、現時点ではPS~1、75歳未満のOsimertinib PD後の2次治療に関して強固なエビデンスのある治療はないとしか言いようがありませんが、少なくともプラチナ併用の化学療法にICIを加える治療が望ましいのではないかと思われます。
使い分けとしては、色々な考えがあるとは思いますが、大きく分けると、、
・PEMが使用可能か
・bevacizumabが使用可能か、もしくはbevacizumabの上乗せに期待出来るか
になるのではないでしょうか。
PEMに関しては間質性肺炎やCcr:45ml/min未満の腎機能障害がある症例に関しては使用する事は難しいです。
腎機能障害がある症例に関しては、CBDCA+nab-PTX+Atezolizumabを使う事が多いかと思います。実際現在、腎機能低下進行非扁平上皮非小細胞肺癌を対象としたCBDCA+nab-PTX+Atezolizumabの有効性を検討する第2相試験が進行中です。(LOGIC2002試験)
間質性肺炎を有する患者では通常TKIを使用しないので、通常は現在の議論には関係ないことかと思われます。
ちなみにいうと、間質性肺炎合併の切除不能NSCLCに関して、間質性肺炎がUIP patternではなく、%VC≧80%を満たす症例(18例)に関してNivolumabの安全性と有効性を検討した試験があり奏効割合 39%,PFS中央値 7.4 ヵ月、OS中央値 15.6 ヵ 月(Lung Cancer. 2017;111:1-5.) と有望な結果がえられています。
間質性肺炎合併肺癌であれば、すべてICI禁忌ではなくなってきています。
bevacizumabに関しては、以前から胸水症例に関しては胸水コントロールが得られやすい事は報告されています。
さらにIMpower130試験、IMpower150試験の結果を基にすると肝転移症例に関してはBevacizumabの上乗せ効果がありそうです。
吸入薬処方で考える様々な事。その1
COPD、喘息に関して治療の根幹は吸入薬である事に疑い様は無く、様々なエビデンスが創出されています。
ただ臨床試験での効果には、コンプライアンスが維持されている事が前提となる事と、実臨床で診ている患者と臨床試験で組み入れられた患者層が一致しているかを考える事が重要かと思います。
3剤吸入(ICS/LABA/LAMA)に関する最も有名な論文の一つであるIMPACT study (N Engl J Med 2018; 378:1671-1680) を例に挙げて説明します。
(略語 ICS:吸入ステロイド、LABA:長時間作用型β2刺激薬、LAMA:長時間作用型抗コリン薬)
FLAME study (N Engl J Med 2016; 374:2222-2234)を元に以前は中等症以上のCOPDへの吸入薬はLABA/LAMAが主流でした。ただ中等症~重症COPD患者にICSを追加する事で1秒量の減少を低下させる事が出来て、COPD増悪の頻度も減らせる事が出来るものの肺炎の頻度は増加する事が知られていました。(N Engl J Med 2014; 371:1285-1294、N Engl J Med 2020; 383:35-48、N Engl J Med 2007; 356:775-789)
そこで、ICS/LABA/LAMA3剤を合剤にして一つのデバイスにまとめてしまい治療した場合どうなるかを検討した試験がIMPACT試験です。がっつりグラクソスミスクラインの支援を受けた試験です。
結果としては、中等症~重症のCOPD増悪が生じる頻度は3剤(ICS/LABA/LAMA)群で0.91/year、ICS/LABA群で1.07/year (HR:0.85 ,95%CI: 0.80-0.95)、LABA/LAMA群で1.21/year (HR:0.75 ,95%CI: 0.70-0.81) であり優位に3剤で増悪頻度は減少したとの事でした。
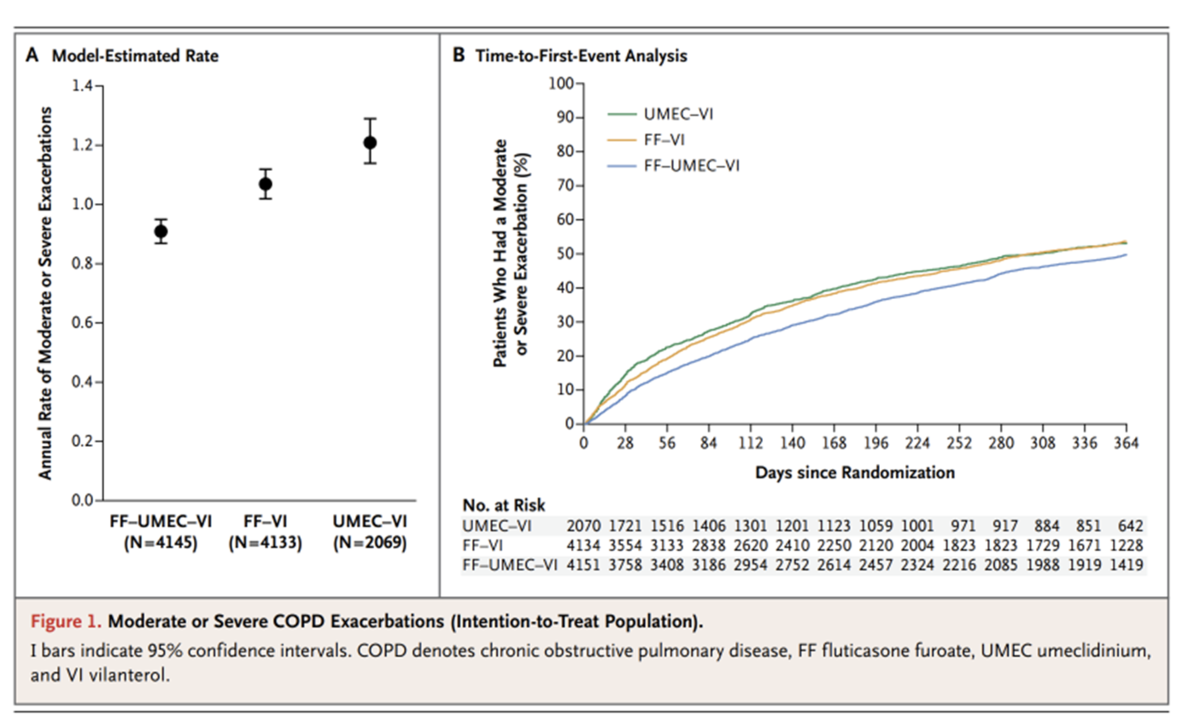
肺炎の頻度に関しては3剤群で8%、ICS/LABA群で7%、LABA/LAMA群で5%とLABA/LAMAとLABA/LAMA群で肺炎の合併症が低い傾向にあるとの事です。(HR:1.53 95%CI:1.22-1.92; P<0.001) ただ肺炎自体は軽症が多かったとの事です。
これを元にCOPDに対しても3剤(ICS/LABA/LAMA)で治療する事が増えている印象です。
ただ今回のIMPACT試験に関して注目すべきはその”method”と”患者背景”です。
組み入れられているのは、
・40歳以上のCOPD患者
・CAT(COPD Assesment Test) 10点以上
・%1秒量:50%未満で少なくとも1回以上の中等症~重度のCOPD増悪歴が過去1年以内にある。
・%1秒量:50~80%で2回以上の中等症のCOPD増悪もしくは1回の重度のCOPD増悪が過去1年以内にある。
・ランダム化される2週間は元々の吸入薬を継続出来る。
とされています。
中等症の増悪:抗菌薬や全身ステロイド投与が必要であるが、外来で治療可能。
重症の増悪:入院が必要もしくは死亡症例。
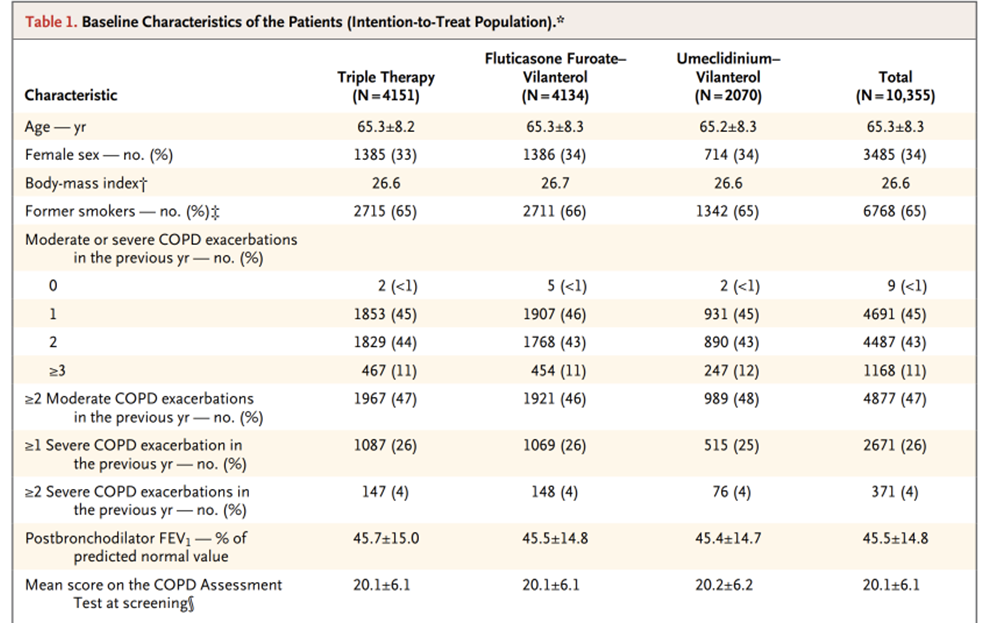
それを元に組み入れられた患者数が10355人で、それらの患者背景がtable1にまとめられています。
さて、色々と考えさせられる事があります。
実臨床で出会うCOPD患者はどんな感じでしょうか?
普通は高齢で痩せている男性が多いかと思います。
先程のIMPACT試験では年齢の中央値が65.3歳で、BMIの中央値が26.6(!)
そこそこ若くて、体格がしっかりしたCOPD患者が対象になっているのです。その様な方々が少なくとも1年以内に1回は全身ステロイドが必要か入院する様な増悪をしているって普通にある事でしょうか。COPDだけでなく、喘息発作の要因も重なっているとも考えられるかもしれません。ICSを加える事が有利な結果になりそうですね。
COPDに関する臨床研究で喘息要素を除外しても半数程度は喘息の特徴を有していたとの報告もあります。
実際に今、あなたが診ているCOPD患者さんと臨床試験での患者背景が似ているかどうかを判断する事は重要で、盲目的に"positive study"を信じる事は危険な事かと思われます。
(余談:COPDには2パターンありpink pufferとblue bloaterがあります。pink pufferは日本人で多い様な、痩せ型で気腫肺優位なCOPD。(図左)それに対してblue bloaterは慢性気管支炎タイプが多く、痰の量が多いと言われています。(図右)blue bloaterと言われているのは体格が良く、容易にチアノーゼを呈するからとされていて欧米に多いタイプのCOPDみたいです。前述のIMPACT試験の患者層でBMIが比較的高いのはblue bloater タイプが多く組み入れられているからかもしれません。ちなみにIMPACT試験では日本人の割合は4%との事です。) Int J Chron Obstruct Pulmon Dis
. 2019 Dec 6;14:2849-2861.

(ネッター解剖学より)
IMPACT試験ではアドヒアランスの維持と増悪しているかどうかの判断のために電子日記を用いて症状などを毎朝記録する必要がありました。アドヒアランス不良と吸入デバイスの操作ミスは考慮されていない事になります。これも実臨床とは乖離している事かと思われます。
実臨床では吸入薬のアドヒアランスを維持する事は難しいです。当たり前ですが、アドヒアランスを維持出来れば、症状コントロール、肺機能も良好になり、医療コストの低下にもなるという報告もあります。(Respiratory Medicine (2013) 107, 1481e1490)
吸入デバイスの誤使用も重要な問題です。
一つ論文を紹介させて頂きます。
Eur Respir J 2017; 49: 1601794
実臨床での吸入デバイス手技とCOPD増悪の関係を明らかにする事を目的とした論文です。フランスの212施設の家庭医(GP)、50人の呼吸器内科医が参加し、2935人のCOPD患者が対象となりました。
評価されたデバイスは、
・ブリーズヘラー
・ハンディヘラー
・pMDI
・レスピマット
・タービュヘラー
が対象です。エリプタ製剤は含まれていませんでした。
それぞれデバイスを使用する手順のどこに失敗があったかと言うと、、
・ブリーズヘラー
カプセル挿入のミス、噴霧するためのボタンを押して離す過程でのミス、吸入後もカプセル内に吸入薬が残っている。
レバーの操作ミス、残数が無いにもかかわらず吸入した。
・ハンディヘラー
カプセル挿入ミス、噴霧するためのボタンを押して離す過程でのミス、吸入後もカプセル内に吸入薬が残っている。(当然ながらブリーズヘラーと同じ様なミスです)
・pMDI
吸入タイミングが合わない
・レスピマット
装置内にカートリッジがない、用量カウンターに用量が残っていないにもかかわらず操作してしまった。台座のねじれの失敗、手の動作と吸入の同期不良。
・タービュヘラー
グリップを時計回りに回し、反時計回りに「カチッ」と音がするまで回す過程でのミス、用量カウンターに用量が残っていないにもかかわらず操作する。
この論文ではデバイスにかかわらず操作ミスは50%以上でみられたとの事です。
デバイス毎には
ブリーズヘラー:15.4%
ディスカス:21.2%
ハンディヘラー:29.3%
pMDI:43.8%
レスピマット:46.9%
タービュヘイラー:32.1%
で操作ミスがあったとの事で、ブリーズヘラーが最もミスが少なく、レスピマットが最もミスが多かったとの結論になっていました。
また、重度のCOPD悪化のために過去3ヶ月間に入院や救急外来を必要とした患者の割合は、エラーがない場合は3.3%(95%CI 2.0-4.5)、重大なエラーがある場合は6.9%(95%CI 5.3-8.5)(OR 1.86、95%CI 1.14-3.04、p<0.05)であったとの事です。
デバイス操作ミスは重要な問題にも関わらず、過小評価されているかも知れません。
(というか、デバイスミスに気づけていないし、重要な問題と認識されていないかも知れません)
初めて処方された場合は、薬剤師もしくは看護師などから吸入手技の説明がされるはずですが、再指導されている頻度は少なく、55.3%の薬剤師は手技の再指導はしていないとの事です。(長瀬 洋之 他: アレルギー・免疫 2013; 20(9),1332-1347)
高齢者へ吸入薬を処方する時には定期的に正しく吸入出来ているかをモニタリングするシステムが必要かも知れません。
その2に続く。(はず)