呼吸器診断学3
肺腫瘤陰影をみた時の診断の流れを確認していきます。
日本CT検診学会のガイドラインに基づいた、肺結節陰影のフローチャートをお示しします。


充実性性結節と部分充実/スリガラス陰影で対応が異なっています。
充実性結節
10mm以上もしくは、10mm以下でも経過観察中に増大傾向がある時(2mm以上の増大)がある時には、確定診断を行う事が推奨されています。
確定診断の方法に関しては以下の方法があります。
① 気管支鏡検査
② CTガイド下生検
③ 局所麻酔下胸腔鏡
④ 手術生検
⑤ その他 (リンパ節生検、皮膚転移の生検、EUS/FNAなど)
それぞれどの様なメリット、デメリットなどがあるかを表にしてまとめてみました。

気管支鏡検査を行うかどうかは、「腫瘍に枝が入っているかどうか」が重要になります。「bronchus sign」とも言います。事前に1~2mm厚のHRCTを用意しておくと、気管支鏡の枝読みには有用です。
最近では進行肺癌の治療前には各種遺伝子変異、PD-L1の検索が必須になっています。以前はEGFRやALKなどを1つずつ提出していましが、現在ではオンコマインDx®などの
NGSやAmoyDx®といったマルチ遺伝子PCRを使用して遺伝子変異を検索します。そのためにはある程度の組織量が必要となります。(オンコマインDxの場合5μmの未染スライド10枚)
手術や放射線治療前で「診断のみ」で良い患者と、進行肺癌で今後化学療法を要する患者で「診断に加えて、バイオマーカー検索も必要」という患者では気管支鏡検査での検体の質と量が異なってきます。
気管支鏡検査ではEBUS-GSという、超音波とシースを使用した方法が一般的で、診断率が70%程度から80%程度まで向上すると言われています。その反面、シースを使用するので鉗子のサイズが小さくなり、組織量が減ります。
組織量をカバーするために生検回数を増やすか、超音波で腫瘍の存在を確認した後にあえて、組織量を確保するために、シースを使わずに通常の鉗子を使用して組織量を増やす方法もあります。また最近ではクライオ端子を使用して凍結させた検体を取ってきて、確実な組織量を担保する方法も出てきています。
EBUS-TBNAといって、縦隔リンパ節(#2、#4、#7、#10、#11など)を超音波を用いて穿刺して、組織を採取する方法もあります。慣れると案外、通常の鉗子を用いた生検よりも確実に組織を確保出来る様になります。
末梢の原発巣と縦隔リンパ節転移があり、リンパ節が刺しやすい(#7、#4Rなど)の時にはあえて原発を生検せず、十分な組織を確保するために縦隔リンパ節にEBUS-TBNAでアプローチする場合も多いです。
ただ、気管支鏡検査で診断するだけで無く、診断したその先も意識した組織採取が求められている時代になっています。
その点CTガイド下生検や局所麻酔下胸腔鏡の場合はバイオマーカー検索にも耐えられる様な確実な組織量を確保しやすいとは言われています。
CTガイド下生検は、気管支鏡が届かない末梢病変や腫瘍に気管支の枝が入っていない病変では良い適応になります。(肺尖部や肺底部などは気管支鏡が届かない病変の代表です)
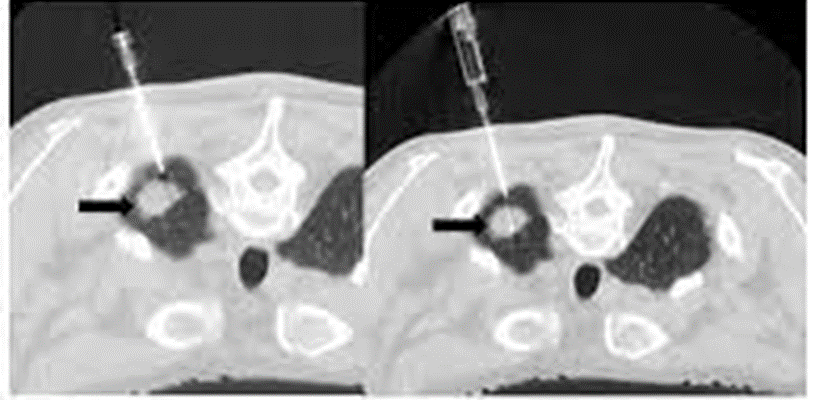
(日本IVR学会HPより)
CTガイド下生検は肺だけでなく、CTガイド下で骨や胸膜を生検する場合もあります。
CTガイド下生検が望ましくないのは
・原発巣が小さく安全な穿刺が困難
・肺門部や縦隔など病巣が中枢側にある
・仰臥位での安静が困難
などがあります。
原発巣が小さく、胸水は無いものの遠隔転移がありバイオマーカー検索は必要ではあるものの、気管支鏡も届かず、CTガイド下生検にも局所麻酔下胸腔鏡も困難な場合があります。
その場合でも確実な診断と組織量を得る努力は必要になります。
上記で示していない肺癌の診断オプションとしては、EUS-FNAがあります。
アグレッシブな施設では呼吸器内科医がEUS-FNAを自分で行う所もあるみたいですが、多くは消化器内科に依頼します。
具体的には食道から縦隔にある病変をEUS-FNAで採取したり、胃に送気して膨らませて左副腎からEUS-FNAで組織採取する方法もあります。
それでも組織採取が難しい時にはⅣ期で進行した肺癌にもかかわらず、組織採取のために手術をお願いする場合もあります。
そこまで進行肺癌に対する組織採取の重要性が増してきているのです。