睡眠時無呼吸症候群の身体所見
以外とガイドラインにも記載が無いし、体系的に学ぶ機会が少ない事かと思われます。
・Cricomental Space

(JAMA August 21, 2013 Volume 310, Number 7より引用)
上記の様に下顎と輪状軟骨を結んだ線をCricomental Spaceと言います。この長さが1.5cm以上であるとOSASの可能性は下がります。
Cricomental Spaceが1.5cmより大きければAHI10以上のSDB(睡眠関連呼吸障害)は、100%除外出来るという報告すらあります。
(Am J Respir Crit Care Med Vol 167. pp 1427–1432, 2003)
・Pharyngeal grading
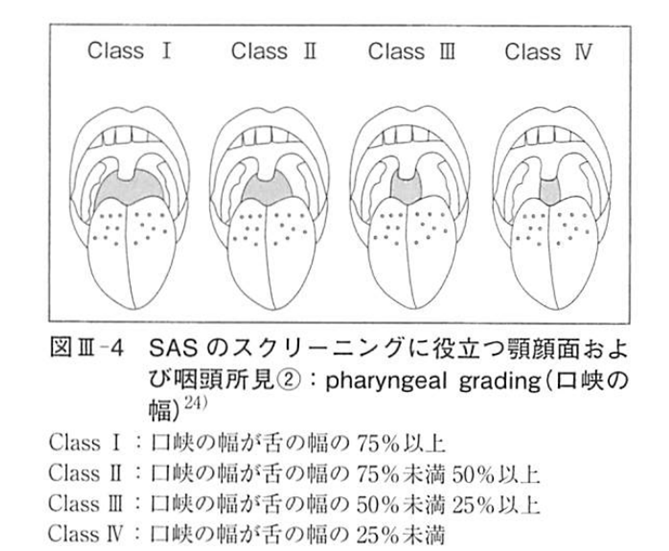
(榊原博樹先生 睡眠時無呼吸症候群診療ハンドブックp160から抜粋)
咽頭所見のGradeです。
日本人男性での研究で、AHI10以上のSDBに対してOdds比は2.92との事です。
上記2つのCricomental SpaceとPharyngeal grading組み合わせた表もあります。
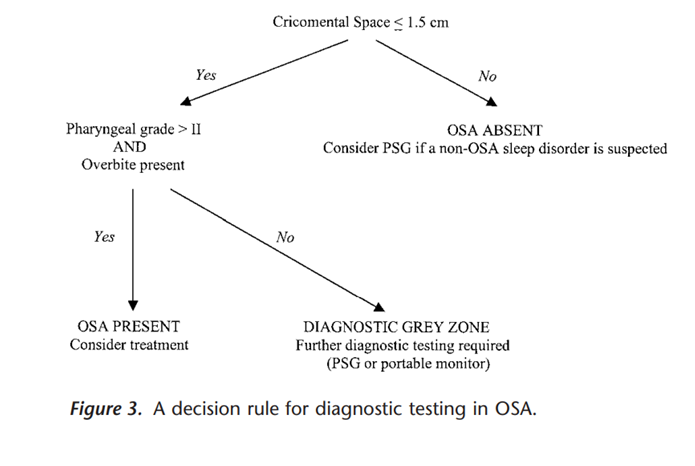
Cricomental Spaceが1.5cm以上であればOSASを否定して良いとなっています。ただCSASなどOSAS以外のSASの可能性があり、眠気など症状があればPSGに進みなさいとなっています。
Cricomental Spaceが1.5cm以内であれば、Pharyngeal gradingに進みます。Pharyngeal grade 3以上であれば、特異度100%でOSASありとしています。PSGすら挟む余地すら与えていません。すごい自信ですね。自分なら一端簡易検査だけでも挟みたいと思っていまいます。
Pharyngeal grade 2以下であればグレーゾーンでありPSGに進むべきとしています。
JAMA August 21, 2013 Volume 310, Number 7では、狭い咽頭所見はAHI10以上とした時のOSASへの感度は58%、特異度67%、LR+:1.4とそこまで特異性の高い所見とはなっていません。
なのでPharyngeal gradeだけで流石にPSGをすっ飛ばすのはどうかと思います。
とういうか、日本の保険診療上簡易検査でのAHI40以上または、PSGでのAHI20以上が必要ですしね。
・マランパチ分類
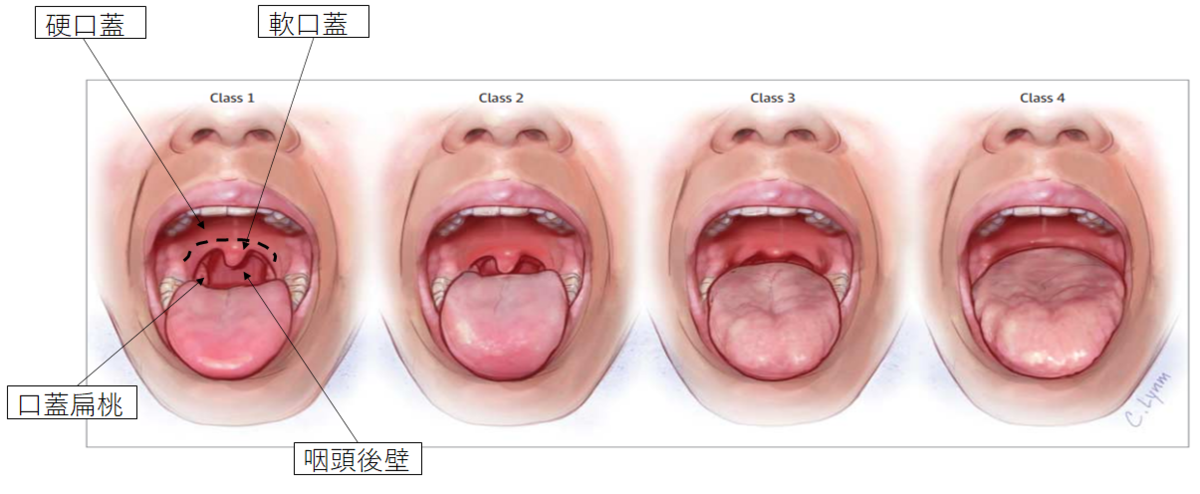
全身麻酔前の挿管困難を予測するための指標です。
クラス1:口蓋弓、軟口蓋、口蓋垂ともによく見える
クラス2:口蓋弓、軟口蓋は見えるが、口蓋垂の先端は見えない
クラス3:口蓋垂の基部と軟口蓋しか見えない
クラス4:軟口蓋は見えず、硬口蓋しか見えず
とされています。
SDB(睡眠呼吸障害)、OSASにはクラス3/4が多く日本人データでAHI10以上のOdds比は4.14とされています。
そこまで有用な印象は無かったのですが、スクリーニング的に確かめる分には良いかもしれません。
・下顎の後退
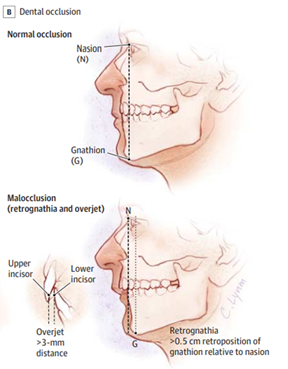
下顎後退は、側面で下顎前端と額上顎前端の最後方点を結んだ線より後方に位置される事から診断されます。
個人的にはバナ●マンの日●さんみたいな顔を言っています。
ただあまり診断精度は高くは無い様です。日本人では比較言われて的下顎後退が多いといわれています。下顎の解剖学的構造は人種差がありそうです。
・肥満
OSA最大の危険因子が肥満です。10%の体重増加は中等症OSASを発症するリスクが6倍と言われています。(JAMA 2000;284:3015-3021)
日本人の男性を対象とした研究で、BMI>25.9以上の対象者では50%以上がRDI(呼吸障害指数)>15以上であったとする報告もあります。
NEJMのOSASの総説でもBMI≧30以上や首周りが男性の場合43.2cm以上、女性の場合38.1cm以上は強くOSASを疑う所見とされています。
簡単ではありますが、OSASの身体所見でした。ご参考になれば幸いです。
EGFR陽性、PD-L1高発現NSCLCへの抗PD-1/抗PD-L1阻害薬に関して
以前からEGFR陽性非小細胞肺癌(NSCLC)に関して、抗PD-L1阻害薬の効果が乏しい事は言われています。ただKeynote024試験に端を発し、PD-L1≧50%などの高発現群では抗PD-1阻害薬が有効である事は、肺癌領域では、もはや常識になりつつあります。(もちろんPD-L1高発現だけでは効果予測には不十分かも知れませんが、、)
現在の流れとしてEGFR遺伝子変異陽性の切除不能肺腺癌の一次治療として、Osimertinibが使用される事が多いと思われます。
1世代・2世代のTKIで治療開始した場合にはT790Mの発現有無は大事な問題ですが、上記の様にOsimertinibで治療開始した場合はT790Mは関係ありません。
ではEGFR陽性で1st line OsimertinibでかつPD-L1高発現のNSCLCに関して最適な二次治療とは如何なものなのでしょうか。
ICIが無かった時代にはドライバー変異陰性の場合の1次治療に準じる事が多く、プラチナダブレットで殺細胞性抗がん剤を使用していたと思います。現在はPD-L1:50%以上であればICI単剤もガイドラインでは推奨されてはいます。
ただ、EGFR陽性であっても、PD-L1:50%以上の高発現ではICI(免疫チェックポイント阻害薬)は有効でしょうか。
まず、PD-L1:高発現ではプラチナダブレットに比べてPembrolizumab単剤での有効性が示されたKyenote024試験ではEGFRやALK陽性は除外されていました。EGFR陽性かつPD-L1≧50%で、TKI未治療患者にPembrolizumabを投与して研究(J Thorac Oncol. 2018 August ; 13(8): 1138–1145. )がありますが、有効性は示されず、EGFR陽性・PD-L1:高発現患者への1st line のICI使用をすべきでは無いという結論でした。
EGFR陽性患者へのICI単剤は使用すべきでは無いでしょう。
有名な試験でIMPOWER150試験があります。いわゆる、ABCP(Atezolizumab+Bevacizumab+CBDCA+PTX)のレジメン根拠となっている研究です。
先行するKyenote024や189試験と異なっているのは、EGFR・ALK陽性患者を含み、探索的研究として肝転移患者でのサブグループ解析を用意していた事と思います。
EGFR・ALK陽性のサブグループ解析では、コントロール群に比べて、HR:0.54(0.28-1.03)と有効性が示されていました。
上記をもって、最近ではEGFR陽性で1次治療タグリッソを使用した場合は、2次治療としてABCPを使用する事が多くなっています。
ただ、ABCPはベバシズマブを含むレジメンです。扁平上皮癌や気管浸潤、血痰の既往があるなどベバシズマブを使用出来ない症例は少なからずあります。ベバシズマブが使用できない様な時はどの様にするべきでしょうか。
一つの選択肢はIMPOWER130レジメンを使用する事です。IMPOWER130試験は非小細胞肺癌に対して化学療法とICI(Atezolizumab)の併用を検証した第3層試験です。ここで使用されているレジメンはCBDCA+nab-PTX+AtezolizumabでEGFR陽性患者も除外はされてはいませんでした。全体ではPFS、OSともに化学療法単独に比べて優位な延長が得られました。(12か月時点でのPFS:ICI+ケモ群:29.1%、コントロール群:14.1%、HR:0.64、12か月時点でのOS:ICI+ケモ群:63.1%、コントロール群:55.5%、HR:0.79)
ただ、EGFR・ALK陽性患者に限ればHR:0.98で1をまたぎ、優位な効果は得られてはいませんでした。
悩ましい所ではありますが、Kyenote189ではEGFR陽性が除外されているのでエビデンスが無いので、まだIMPOWER130レジメンの方がましかもしれません。
ですので結論としては、
EGFR陽性で1st line OsimertinibでPDとなった時の2nd lineの候補としては、、
・CBDCA+PTX+Atezolizumab+Beva
beva 不適の場合は
・CBDCA+nab-PTX+Atezolizumab
・CBDCA(or CDDP)+PEM+Pembrolizumabになるかと思います。
もちろん、IPがあるとか自己免疫性疾患があるなどICIが使用できないときには化学療法単独となると思います。
また問題となる事はTKIのre-challengeの可能性です。
基本的にはICIを使用した直後にTKIを使用する事は間質性肺炎のリスクになるので避けられるべきです。
ただ、ICI使用後、TKIが使用できないかというとそういう訳ではなく、ICI使用後6か月すれば基本的にTKIを安全に使用可能と言われています。
ですのでICIを使用するにしても、PSが比較的保たれているearly phaseの方が望ましいのではないかと思います。
上記2nd lineの候補のレジメンでPDとなった時に、3rd lineの候補として、、
PEM 未使用であれば、PEMを使用する。
Beva使用可能症例はDTX+RAMなどを考慮して、最終ICI投与からの時間を稼ぎ、PSが低下したら、TKIのre-challengeが良いのかと思っています。
自験例で、EGFR(Ex21L858R)陽性かつPD-L1:65%の高発現の患者に1st line Osimertinib投与 したものの4ヶ月でPDとなった症例を経験しました。FLAURA試験でのOsimertinibのPFSが18ヶ月であったのと比べると明らかに短い期間でした。
2nd line でABCPを選択しましたが、奏功しています。
呼吸器診断学
論文紹介も良いのですが、中々続かないので自分の興味がある事を紹介して参りたいと思います。
”呼吸器診断学”
に関して自分が考える事を紹介して参ります。
診断のオプション
・仮説演繹法
・Semantic Qualifier (SQ)
・illness script (疾患の典型例)
・徹底的検討法
- vindicate-P
- anatomy
・ Pivot and Cluster Strategy(PCS) :ピボットクラスター戦略
・アルゴリズム法
・パターン認識(snap shot diagnosis )
・ Rule out worst-case scenario 法
などがあります。
仮説演繹法に関しては聞き慣れない方もいるかと思い解説していきます。
仮説演繹法とは、帰納法によって仮説を作り、それを演繹法によって検証可能な予測にし、仮説を検証する手法です。
これだけでも言ってもよくわからないと思います。
例えば、「1時間前からの胸痛」、「左肩に痛みが放散する」、「喫煙歴あり」、「既往歴に糖尿病、高血圧」などの情報から、”心筋梗塞”という仮説を設定する。このプロセスの事を帰納法と言います。さらに”心筋梗塞”という仮説を元にして「心電図でST上昇」という予測を立て、実際に心電図を測定する事で検証するこのプロセスを演繹法と言います。合わせて仮説演繹法です。かっこいい言い方ですが、実は診断の過程で医師が自然と行っている事と思います。
もちろん仮説を元にして検査の予測を立てたものの、その予測が外れる事もあります。その場合は、再度情報を収集して新たな仮説を設定して、検証いていく事に戻ります。
例えば、
特に既往の無い50歳台の女性が、5日前頃からの右下腹部痛を生じて救急外来を受診したとしましょう。疼痛の移動は無く、先行する食思不振も無かったとしましょう。
ただ発熱があり、診察では右下腹部に圧痛がありました。
あなたは上記の情報から、”急性虫垂炎”という仮説を設定し、その仮説を立証するために腹部CTを撮影して、その結果虫垂の腫大など虫垂炎の所見がある事を予測したとします。
しかし、腹部CTでは虫垂腫大が無かったとしましょう。その場合は提示した仮説が棄却された事になり新たな仮説を設定する必要が出来ます。
振り返ると、虫垂炎にしては典型的なプレゼンテーションでは無く、5日前からと少し長めの病歴である事に気づくかもしれません。
虫垂炎と鑑別を要する疾患で、”憩室炎”を想起するかもしれません。
そこで改めてCTを確認すると、憩室炎の所見があり診断に至れたという事もあるかもしれません。
仮説演繹法の良い所は、何度でも仮説を設定して検証出来る事です。ただ、最初の仮説設定を間違えると、正しい診断に至る事が難しくなるかもしれません。
ポイントは、様々な情報から確からしい仮説を設定するという所です。別の言い方をすると「事前確率」と言えるかもしれません。
事前確率を無視すれば、例え優れた検査でも意味をなしません。事前確率が低い疾患を想起して、それを検証する検査を行って陽性であっても事後確率は高く無く、(これをベイズの定理で説明可能です)、出てきた結果に振り回されてしまいます。
こういった事象を「ユリシーズ症候群」と言うそうです。
ユリシーズ症候群にならない様に気をつけなければなりません。
この仮説設定をより洗練して行う手段が、
Semantic Qualifier (SQ) です。
直訳すると、「意味のある修飾詞」
これは元々二項対立の概念からきたものらしく、黒⇔白、正義⇔悪、大きい⇔小さいといった相反する概念を修飾語に用いる事です。
医学に当てはめると、急性⇔慢性、間欠的⇔持続的、初発⇔再発性などという変換ワードが出てきます。
以下は例です。

「胸痛の鑑別を挙げて下さい」というと、鑑別が多すぎて、意味の無い質問になります。そこでSQを使い、病歴をまとめる事で、鑑別すべき疾患が絞られます。
具体例を挙げて説明します。以下架空の症例です。
「55歳男性。職業は長距離トラックドラーバーで、独身。食生活は外食が多く、塩分や油分など特に気にしていない。以前から検診で高血圧を指摘されていたが放置していた。喫煙は30本/dayを35年間で現在も継続している。心疾患の家族歴はなし。
以前から胸痛を自覚する事はあったが、短時間で治まるので放置していた。来院数時間前に安静時で前胸部痛が出現し、左下の奥歯が浮く様な痛みも伴った。胸痛が続く事から救急外来を受診した。」
如何でしょうか。急性心筋梗塞の典型的なプレゼンテーションを用意しました。
この病歴をSQを用いて要約していきます。「55歳男性。職業は長距離トラックドラーバーで、独身。食生活は外食が多く、塩分や油分など特に気にしていない。」はどの様な変換ワードにしましょうか。50歳でも60歳でも鑑別に大きな影響は無いと思います。55歳というのを「壮年期」という一言にまとめられます。トラック運転手である事も鑑別に大きく関わるかというと、そうでも無いかもしれません。思い切ってまとめると、「心血管リスクを有する壮年期男性」になります。この文言で喫煙歴の事も含められます。
「以前から胸痛を自覚する事はあったが、短時間で治まるので放置していた。」
この病歴は狭心症を示唆します。心筋梗塞を想起するために重要です。「前駆症状あり」とまとめられるかもしれません。
「左下の奥歯が浮く様な痛みも伴った。」
これは、放散痛ありという事になります。
上記SQを意識した病歴要約をすると、、、
「心血管リスクを有する壮年期男性で、前駆症状と放散痛を有する急性発症の前胸部の持続痛」
となります。
「胸痛」の鑑別では何が何だかわかりませんが、上の様にまとめられると、「急性心筋梗塞」という診断仮説が容易に出てきます。
個人的にはSQのイメージは「分断」です。
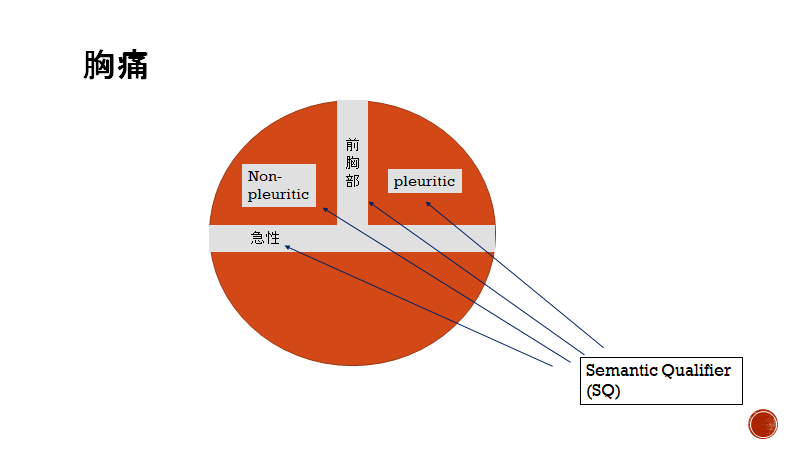
複数の診断仮説を同時に異なった検査などで検討していく事も想定されます。
その場合、正しい診断に導くために重要となるのが、「illness script] 病気の典型例でです。
設定された診断仮説の「illness script」と実際の症例を照らし合わせて、「合う点」、「合わない点」を比較検討します。
比較していく過程で、より確からしい診断仮説を選択して詳細に検証していく事が可能です。
普段から様々な疾患の「illness script」を貯めておく事が診断学には重要な事と思います。
熟練した内科医であればあるほど、その人が持つ「illness script」の数が多く、さらに洗練されている様に思います。
最後にPivot and Cluster Strategy(PCS) :ピボットクラスター戦略について触れたいと思います。これは獨協医大総合診療科の清水太郎先生が提唱している方法です。
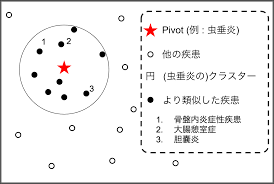
虫垂炎という疾患の典型例は、「急性発症の右下腹部痛」になると思います。ただ、このまとめでは、急性虫垂炎以外も鑑別に入ってきます。例えば、憩室炎、閉鎖孔ヘルニア、メッケル憩室炎、腹膜垂炎、回盲部炎(キャンピロ、エルシニアなど)、悪性リンパ腫、腸結核などです。
なので、「虫垂炎」という疾患仮説を挙げた時点で、臓器に関わらず同様のプレゼンテーションを起こす疾患を想起する事で、鑑別の漏れを無くそうという概念と理解しています。
個人的にはPCSが相応しい疾患とそうで無い疾患がある様に思っています。
PCSが有用な有名な疾患は「PMR:リウマチ性多発筋痛症」です。PMRは除外診断であるし、鑑別も以外と多岐に及ぶので、このPCSを利用するのは理にかなっていると思います。
呼吸器内科的にもPCSが有用な疾患概念はあります。
例えば、「気管支喘息」です。気管支喘息を想起した時点で、心不全を除外すべきと思います。また気管支結核や再発性多発軟骨炎、EDACなども喘息に間違えられるケースがあります。喘息が先行する疾患として、EGPA(旧チャーグストラウス症候群)、ABPA(アレルギー性気管支アレルギー症)もあります。もちろんCOPDの合併(ACO)もあり得ます。
他にもIgG4関連疾患、多中心性キャッスルマン病、TAFRO症候群、POEMS症候群は同一カテゴリーになると思います。
間質性肺炎急性増悪の呼吸管理
かねてから間質性肺炎急性増悪の呼吸管理に関しては、ネーザルハイフローが良いのではないかと考えていました。
NPPVであれば、長期間の装用に耐えられないし、IPPVでも同様ですが、高いPEEPや肺胞にかかる圧により人工呼吸関連の肺障害を起こすのでは無いかと考えていました。
間質性肺炎急性増悪に対して、IPPVを導入して急場をしのいでも、ICU-AWやステロイドミオパチーでADL低下して、長期療養を強いられてしまう事が多い様に感じています。
今回紹介する論文は後ろ向きコホートで、間質性肺炎急性増悪に対してNPPVとHFNCでの呼吸管理を比較した論文です。
Nagoya J. Med. Sci. 82. 301–313, 2020
doi:10.18999/nagjms.82.2.301
High-flow nasal cannula therapy for acute respiratory failure
in patients with interstitial pneumonia:
a retrospective observational study
ネーザルハイフロー(HFNC)は急性呼吸不全に対して、生存率向上に寄与している。しかしながら間質性肺炎急性増悪による急性呼吸不全増悪に対するHFNCの役割はわかっていない。この研究の目的は、間質性肺炎による呼吸不全に対するHFNCとNPPVの効果を比較する事である。この後方視的研究では32人の間質性肺炎急性増悪による急性呼吸不全患者が含まれ、13人がHFNCで19人がNPPVであった。臨床的な特徴、挿管率、30日死亡率がHHNC群とNPPV群で分けて検討された。30日死亡率の解析はロジスティック回帰分析を用いて解析された。HFNC群では高い平均血圧であった。(HFNC群:平均血圧92mmHg、NPPV群:平均血圧74mmHg)でHFNC群で APACHEII scoreが低い傾向があった。(HFNC群22、NPPV群27) 30日時点での挿管率には優位な差は無かった。(HFNC 群 vs NPPV 群 8% vs 37%: p=0.069) 30日時点の死亡率はそれぞれ、23%と63%であった。HFNCは単変量分析において30日死亡率の重要な決定要因であり、多変量解析における30日死亡率の独立した有意な決定要因であった。(odds ratio, 0.148; 95%
confidence interval, 0.025–0.880; p=0.036) 我々の研究は間質性肺炎急性増悪における急性呼吸不全に対してHFNCが良い治療選択肢である事を示唆していた。今後ランダムか比較試験でのさらなる知見の収集が望まれる。


メトホルミンによる抗悪性腫瘍効果
doi.org/10.1016/j.lungcan.2020.11.011
Lung cancer 151(2021)8-15
メトホルミンによる抗悪性腫瘍効果が期待されている事は過去にも報告はありました。(doi.org/10.2337/dc08-2175)
糖尿病を持つ肺癌の患者にメトホルミンを投与する方法でしたが、今回は糖尿病に関係無くメトホルミンを抗癌剤と併用する試験みたいです。(baselieneでDMがあるのはメトホルミン群で27.8%、コントロール群で16.9%)
基本的には生存率に差が無い様ですが、PETで集積の強い肺扁平上皮癌ではメトホルミン上乗せの効果があるかもとの事です。
安全性としては倦怠感や食思不振などの有害事象はあったものの2群で大きな差は無く、低血糖や乳酸アシドーシスも無かったとの事です。
さすがにDMの有る無しに関係無くメトホルミンを入れるのは乱暴かもしれませんが、DMがあれば積極的にメトホルミンを考慮してもいいかも知れません。
でも選択されている化学療法がCBDCA+GEMみたいですが、今の時代に1st lineがこれは無いけどなあと、、、
目的:
過去のエビデンスからは、抗糖尿病薬であるメトホルミンが、癌代謝をコントロールする事で抗腫瘍効果を持つ事が示唆されてきた。化学療法にメトホルミンを加える事で肺癌患者の生存率改善に寄与するかを評価した。
方法:
このランダム化第二相試験は、化学療法を受けた事が無く、EGFR、ALK陰性のstageⅢb/Ⅳの非小細胞肺癌患者164人が登録された。患者は化学療法にメトホルミン(1000mgを1日2回)加える、もしくは化学療法単独を3週毎に6コース投与した。
患者はゲムシタビン(1000mg/m2)をday1、8にカルボプラチン(AUC5)をday1に投与された。探索的研究が含まれ、血清代謝パネル、PET、代謝関連遺伝子の遺伝子変異とした。
結果:
メトホルミン群はコントロール群に比べて、進行と死亡のリスクに優位差を示さなかった。 (progression: hazard ratio [HR] = 1.01 [95% confidence interval (CI) = 0.72 − 1.42], P = 0.935;death: HR = 0.95 [95% CI = 0.67–1.34], P = 0.757)
扁平上皮癌はbase lineのPETで非扁平上皮癌に比べてPETのFDG集積が優位に高かった。
(p=0.004)
扁平上皮癌でFDGの取り込みが高い場合、メトホルミンの追加により、進行と死亡のリスクが大幅に減少した。 (progression: HR = 0.31 [95% CI = 0.12− 0.78], P = 0.013; death: HR = 0.42 [95% CI = 0.18–0.94], P = 0.035).
HDLコレステロールレベルは、コントロール群と比較してメトホルミン群では治療後に有意に増加した。(P = 0.011)
高インスリン血症や治療後にインスリンレベルが減少した患者に関しても延命効果をもたらさなかった。
結論:化学療法へのメトホルミンの追加は非小細胞肺癌の患者への延命効果をもたらさなかった。しかしながら、FDG取り込みが高い扁平上皮癌に関しては優位に生命予後が延長した。これは、糖代謝に高く依存する腫瘍にメトホルミンが相乗的に抗腫瘍効果をもたらす事が示唆された。



睡眠時無呼吸症候群のCPAP治療
睡眠時無呼吸症候群へのCPAP治療は高いエビデンスがあり効果が実証されています。
35個のRCTをまとめたmeta-analysisではコントロール群に比べてAHIの優位な減少(-33.8 events/hr) があり、ESSを用いた評価で日中の眠気が改善し、血圧低下、QOL改善が示されました。ただ死亡率の減少までは証明はされませんでした。(JAMA. 2017;317(4):415. )
2019年のAmerican Academy of Sleep Medicineのmeta-analysisでは、CPAPは治療しない事に比べて、AHIを減らし(中央値-23/hr 95%信頼区画 -18 ~ -29 events/hr ) 眠気を改善し、血圧を減らし (収縮期血圧 -4.2 mmHg; 95% CI -6.0 to -2.5 mmHg 、拡張期血圧 -2.3 mmHg; 95% CI -3.7 to -0.9) 、交通事故を減らし(HR:0.30)、QOLを改善させる。ただし、死亡率、心血管疾患、気分障害、空腹時血糖、HbA1c、左心機能、入院率には優位差は無かったとしています。 doi: 10.5664/jcsm.7638.
血圧降下作用はありますが、4mmHg程度しか下がりません。
ただ、別の研究にはなりますが、CPAPに加えて減量を指示する事でCPAP単独よりも血圧を下げた報告があります。DOI: 10.1056/NEJMoa1306187
ですので繰り返しになりますが、CPAPだけで無く減量も指示する必要があります。
OSASは、間欠的な低酸素、炎症性メディエーター増加に伴う代謝障害、奇異性呼吸に伴う胸腔内圧低下など複合的な要素があると言われています。
低酸素に対して酸素補給をするだけでは、十分ではなく、夜間の酸素補充とCPAPを比較した試験もあります。心血管疾患、または複数の心血管因子を有する患者において、閉塞性睡眠時無呼吸症候群に関してはCPAPで優位に血圧低下するものの、酸素補充だけではその様な作用はありませんでした。DOI:10.1056/NEJMoa1306766
日本の保険適応では、
簡易検査でAHI≧40もしくは、精密PSGでAHI≧20でかつ、不眠などの症状を有する場合とされています。
ではいざ、CPAPを導入するとなるとどの様な設定を選択すべきでしょうか。
以前はタイトレーションといって、PSGを行いながら、無呼吸/低呼吸、いびきなどの症状を見ながら適正圧を調整する方法が主流でしたが、現在はauto CPAPといって吸気や呼気に合わせて事前に設定された圧の範囲内で機械が自動調整する方法が一般的となりつつあります。マニュアルでのタイトレーションによる方法とauto CPAPではアドヒアランスに差はないと言われています。
ですので、aute CPAPで導入し、圧は4~10cmH2O程度から始める事が一般的です。
CPAP使用患者はアドヒアランス維持が出来ず、drop outする患者も多いです。どの程度の使用でアドヒアランスが保てているかというと、
・4時間以上の使用が
・70%以上 とされています。
複数の報告をまとめるとその遵守率が30~60%という報告もあります。
Adherence to Continuous Positive Airway Pressure
マスク
基本は鼻マスクを使用する事が多いです。
他のマスクとしては鼻・口マスク、鼻孔に入れるピロー型があります。
口呼吸が多く、リークが多い時には鼻・口マスクも考慮しますが、
鼻マスク、鼻・口マスク、ピロー型の3つで比べた試験(Chest 153:665-674,2018 )では、鼻・口マスクでは使用時間が短く、CPAP使用時の残存AHIが高いとの報告があります。
マスク変更以外の方法としては、鼻マスクに加えてチンストラップという、口を開けにくくする補助具を使用する事もあります。
もし、CPAPのアドヒアランスを保てない場合には、患者と相談の上、口腔内装置(マウスピース)への変更を考慮します。
口腔内装置は本来軽症~中等症に使用するOSASの治療になります。
AHIを減少させる作用は、複数報告があり、AHIが38±22 からAHI 14±13.2に減量した報告もあります。
保険診療で作成可能です。作成に当たっては歯科に紹介する必要がありますが、出来る歯科医院もしくは口腔外科は限られており、普段から紹介可能な歯科医院を選定しておく必要があると思われます。
3割診療で約1万5千円程度かかります。
睡眠時無呼吸症候群の診療フローチャート
睡眠時無呼吸症候群診療ガイドライン2020を元に作成しました。
ポイントは
・無呼吸を疑う患者では精査を進めながらも生活習慣の是正を行う。
・(記載はしていませんが)問診票だけで除外はせず、診療所でも可能な簡易検査を行う。
・簡易検査でAHI<40ならば専門施設に紹介してPSG施行してもらう。
・PSGでAHI≧20であればCPAP導入考慮する。
・重症SASの患者で(特に若年者)では手術適応を見逃さない。
・CPAP治療が継続困難な場合や軽症~中等症の場合は口腔内装置も治療選択肢になる。
簡易検査では日によってAHIが変動する事もあるので、2回行う施設もあります。2日とも40以上であればCPAP導入で良いでしょうが、1日目40以上、2日目40未満など日によって異なるケースではPSGでの診断確定が望まれるのでは無いかと思われます。
